
Natuurlijke zorg voor moeilijk genezende wonden.
© Madeleine Kerkhof, maart 2019
Huid- en wondinfecties
Onze huid is gekoloniseerd met bacteriën. Sommige hiervan behoren tot de pathogene – dus ziekmakende- bacteriën. Staphylococcus aureus geldt als de meest frequente veroorzaker van bacteriële huidinfecties ( 37%) (1). Verder zien we met name Streptococcus pyogenes en Pseudomonas aeruginosa.
Algemene factoren die het risico op een bacteriële huidinfectie verhogen zijn: een beschadiging van de huid, een verminderde arteriële en veneuze circulatie (bijvoorbeeld door diabetes mellitus), verminderde en lymfe-afvloed, een verminderde algehele weerstand en een verhoogde kolonisatiegraad van bacteriën, bijvoorbeeld door biofilmvorming in open wonden.
De kwaliteit van leven van mensen met een wondinfectie is dan ook vaak ernstig aangetast (2). Een oppervlakkige wondinfectie verstoort de wondheling, maar geneest bij verder gezonde mensen zonder complicaties, al kan het lang duren. Wondinfecties genezen een stuk slechter of niet bij patiënten in een slechte toestand.
MRSA
Een MRSA infectie is een huidinfectie met stafylokokken die niet meer reageert op de gebruikelijke antibiotica’s. In instellingen komt de infectie regelmatig voor bij verzwakte en oudere zorgvragers. De huid kan daardoor steeds ernstiger geïnfecteerd raken.
Bij Manon leidde een blessure van de achillespees na een tweede operatie tot een wondinfectie. Na eerst 8 maanden normaal wondbeleid waarin geen verbetering werd gezien, werd ze behandeld met koolzuur voetbaden i.c.m. een wondgel. Dit leidde in twee maanden tot genezing. Ook werden Bach Bloesemdruppels en TT ter ondersteuning van ontspanning ingezet.
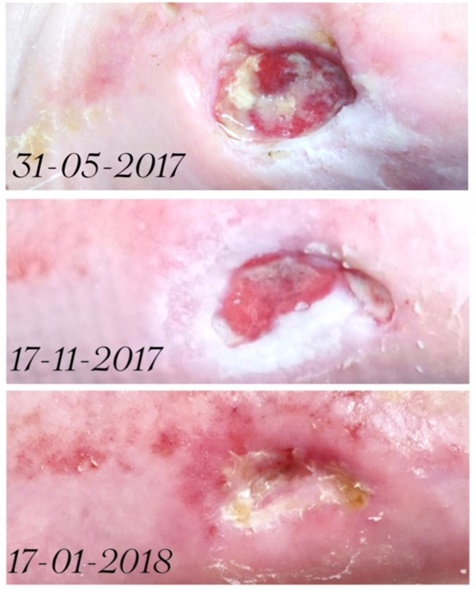
Diabetisch ulcus
Van de mensen met diabetes mellitus lijdt ruim 20% aan polyneuropathie. Van de mensen met diabetes type II heeft 3% een voetwond, die in 23% van de gevallen eindigt in amputatie van de voet, die tevens lijdt tot afname van de kwaliteit van leven van patiënten, hoge kosten en op termijn dito mortaliteit (3; 4, 5; 6; 7). De genezing van een diabetisch ulcus gaat dus vaak moeizaam.
De ervaring leert echter dat essentiële oliën een belangrijke en vaak goed onderbouwde bijdrage kunnen leveren aan het herstel.
Essentiële oliën en wondgenezing.
Met etherische olie en basisstoffen kunnen we de huid verzorgen, infectie helpen voorkomen en verminderen en, waar mogelijk, wondgenezing bevorderen. Essentiële oliën, maar ook sommige basisstoffen en -oliën kunnen een anti-inflammatoire, analgetische en wond helende werking hebben. Een voordeel van het werken met essentiële oliën kan hierbij verder zijn dat niet alleen van sommige oliën is aangetoond dat ze MRSA kunnen bestrijden, maar dat bacteriën niet of nauwelijks resistentie tegen essentiële oliën kunnen opbouwen.
Wanneer de genezing van een wond niet meer verwacht kan worden, kan ook hier AromaZorg bijdragen aan verlichting van symptomen zoals pijn en de aanpak van microben.
Mijn top 10 van essentiële oliën voor de wondzorg zijn:
Kamille, Duitse / Blauwe (Matricaria recutita): anti-inflammatoir, pijn verlichtend, huid kalmerend (8, 9, 10).
Geranium (Pelargonium graveolens): sterk wond en litteken helend, antimicrobieel – ook MRSA – (11, 12, 13, 14).
Helicryse (Helicrysum italicum – Italiaanse of Franse!): sterk anti-inflammatoir, zwelling reducerend, pijnstillend, antibacterieel (15, 16, 17, 18).
Lavendel (Lavandula angustifolia): antiseptisch, anti-inflammatoir, pijnstillend, wond helend (19, 20, 21, 22,).
Manuka (Leptospermum scoparium): krachtig antimicrobieel – ook MRSA (23, 24, 25, 26, 27).
Marjolein, Zoete (Origanum majorana): antibacterieel, antioxidant (28).
Mirre (Commiphora myrrha): pijn verdovend, antiseptisch, antimicrobieel, wond genezend (29, 30, 31, 32).
Pepermunt (Mentha piperita): circulatie bevorderend, pijnstillend, verkoelend, antimicrobieel (33), anti herpes (34), wond heling bevorderend (35).
Sandelhout (Santalum austrocaledonium / spicata): huid kalmerend en regeneratie bevorderend, sterk antioxidatief (36), antimicrobieel (37).
Temulawak (CO2-select extract, Curcuma xanthorrhiza): sterk anti-inflammatoir, antioxidant, antimicrobieel (38, 39, 40, 41, 42, 43, 44).
In de basis (vaak bereid ik magistraal een wondgel) vind ik vooral waardevol:
Aloe veragel (Aloe barbadensis – food grade!): sterk huid kalmerend, verkoelend, helend voor wonden en brandwonden (47, 48, 49, 50, 51, 52).
Calendula (Calendula officinalis – het CO2-total extract): zeer sterk anti-inflammatoir, pijnstillend, wond helend (53, 54, 55, 56, 57, 58, 59, 60, 61).
Duindoorn zaad (Hippophae rhamnoides) CO2-total extract: microcirculatie verbeterend, wond helend op wonden en brandwonden, pijnstillend (62, 63, 64, 65, 66, 67).
Tamanu (Calophyllum inophyllum): anti-inflammatoir, sterk pijnstillend, wond helend (68, 69, 70, 71).
In de praktijk is wondzorg met de hulp van essentiële oliën en basisstoffen nog pionierswerk, maar toch zijn er al zeer goede resultaten geboekt, zelfs bij wonden die met het standaard wondbeleid niet of nauwelijks goed genazen.
Gecombineerde behandeling met Koolzuurbaden
De behandeling van slecht genezende wonden op de extremiteiten kan verder nog verbeterd worden door AromaZorg te combineren met koolzuurbaden. Door het geven van CO2 baden verbetert de doorbloeding in de kleinste capillairen en volgt een betere zuurstofvoorziening van de huid en de dieper gelegen weefsels. In een voetenbad, dat idealiter tot net boven de kuiten reikt wordt door het na elkaar toevoegen van twee afzonderlijke mediatoren koolzuur in fijne blaasjes ontwikkeld.
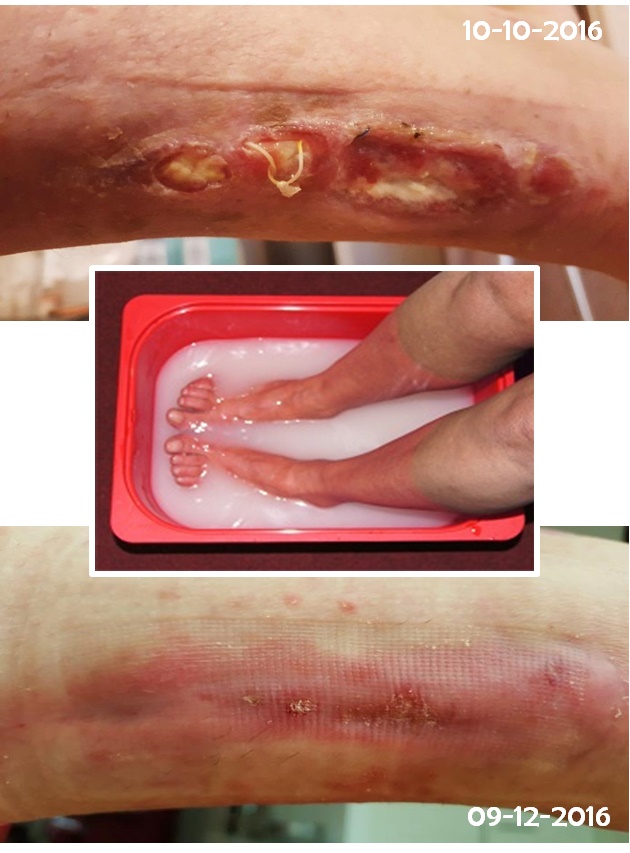
Voor een oudere heer heeft dit al tot excellente resultaten geleid. De ruim 80 jarige Richard was een gelukkig man en al genazen zijn diabetes wonden door zijn voorgeschiedenis en leeftijd niet voor 100%, hij kon daardoor zijn voet behouden en thuis blijven wonen tot zijn overlijden aan een longontsteking medio vorig jaar (zie hierboven).
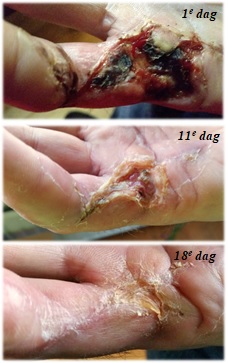
Voor een 50-er wiens vinger na een mislukte huidtransplantatie na een peesoperatie (zie hieronder) niet genas waren de baden en een wondgel genoeg om al na 18 dagen een vrijwel volledige genezing te bereiken.
Koolzuurbaden, met name de voetbaden, vormen een relatief laagdrempelige interventie die significant bij kan dragen aan de doorbloeding en zuurstofvoorziening van het te baden gebied (72, 73, 74, 75, 76, 77, 78, 79, 80). Daardoor verbetert merkbaar en zichtbaar de conditie van de vaten, huid, bewegingsapparaat en zenuwstelsel.
Baden slecht voor wonden?
Sommige zorgprofessionals menen dat het contact met water slecht is voor een open wond, en het is zeker zo dat de interventie zorgvuldig overwogen moet worden. Zelf werk ik altijd volgens vier belangrijke criteria:
- Is de interventie – liefst bewezen – effectief en/of bij juist inzetten veilig?
- Kan de interventie uitgevoerd worden door een bekwame zorgverlener?
- Wegen de voordelen van de interventie op tegen de eventuele neveneffecten en/of risico’s?
- Hebben comfort en welbevinden van de patiënt de hoogste prioriteit?
Een zorgvuldig uitgevoerde interventie houdt in dat de badduur van maximaal 10 minuten plus de maximale watertemperatuur (34-36°C) gerespecteerd wordt, de huid goed droog gedept wordt en gelegenheid krijgt volledig aan de lucht te drogen alvorens te bedekken, en dat de wondgel meerdere malen dun wordt aangebracht. Natuurlijk moet ook goed geëvalueerd worden en gerapporteerd.
Een combi-behandeling met AromaZorg en Koolzuur(deel)baden kunnen tot buitengewoon goede resultaten leiden in de zorg voor slecht genezende en geïnfecteerde wonden. Het heeft, afhankelijk van conditie van de patiënt, wel enige tijd nodig en verdient dat mijns inziens ook. Ik heb gemerkt dat de neiging bestaat natuurlijke wondzorg snel op te geven, maar dat doen we met standaard wondzorg ook niet. Nina en Bob en diverse andere patiënten zijn dankbaar voor de succesvolle aanpak van hun wonden. De kleindochter van Richard schreef mij na het overlijden van haar opa: “Dankzij jouw hulp is mijn opa een hoop ellende bespaard gebleven. Daar zal ik altijd dankbaar voor blijven”. Daar doe ik het voor.
Tot zover dit blog, waarvan een artikel verscheen in de TT Wijzer van maart 2019.
Madeleine.
Referenties:
- 1. Bessa LJ, Fazii P, Di Giulio M, et al. Bacterial isolates from infected wounds and their antibiotic susceptibility pattern: some remarks about wound infection. Int Wound J. 2015 Feb;12(1):47-52. doi: 10.1111/iwj.12049. Epub 2013 Feb 24.
- 2. Badia JM, Casey AL, Petrosillo N, et al. Impact of surgical site infection on healthcare costs and patient outcomes: a systematic review in six European countries. J Hosp Infect. 2017 May;96(1):1-15. doi: 10.1016/j.jhin.2017.03.004. Epub 2017 Mar 8.
- 3. Lenselink, 2012: https://transmuralezorg.nl/images/Wondzorg/symposium30102012/groep_b_diabetische_voet.pdf
- 4. Brownrigg JRW, Davey J, Holt PJ, Davis WA, Thompson MM, Ray KK, et al The association of ulceration of the foot with cardiovascular and all‐cause mortality in patients with diabetes: a meta‐analysis. Diabetologia 2012; 55: 2906–2912.
- 5. Morbach S, Furchert H, Groblinghoff U, Hoffmeier H, Kersten K, Klauke GT, et al Long‐term prognosis of diabetic foot patients and their limbs: amputation and death over the course of a decade. Diabetes Care 2012; 35: 2021–2027.
- 6. Holman N, Young RJ, Jeffcoate WJ. Variation in the recorded incidence of amputation of the lower limb in England. Diabetologia 2012; 55: 1919–1925.
- 7. Kerr M. Foot care for people with diabetes: the economic case for change. NHS Diabetes Kidney Care, 2012.
- 8. Lee et al. Effect of German chamomile oil application on alleviating atopic dermatitis-like immune alterations in mice. J Vet Sci. 2010 Mar;11(1):35-41.
- 9. Koch C, Reichling J, Schneele J, Schnitzler P. Inhibitory effect of essential oils against herpes simplex virus type 2. Phytomedicine. 2008 Jan;15(1-2):71-8. Epub 2007 Oct 31.
- 10. Bensoullah J, Buck P. (2006) Aromadermatoloy – Aromatherapy in the treatment and care of common skin conditions.
- 11. Han X, Beaumont C, Stevens N. Chemical composition analysis and in vitro biological activities of ten essential oils in human skin cells. Biochim Open. 2017 Apr 26;5:1-7. doi: 10.1016/j.biopen.2017.04.001. eCollection 2017 Dec.
- 12. Rosato et al. The inhibition of Candida species by selected essential oils and their synergism with amphotericin B. Phytomedicine. 2008 Aug;15(8): 635-8.
- 13. Shin S and Lim S. Antifungal effects of herbal essential oils alone and in combination with ketoconazole against Trichophyton spp. J Appl Microbiol. 2004;97(6):1289-96.
- 14. Edwards-Jones et al. The effect of essential oils on methicillin-resistant Staphylococcus aureus using a dressing model. Burns. 2004 Dec;30(8): 772-7.
- 15. Han X, Beaumont C, Stevens N. Chemical composition analysis and in vitro biological activities of ten essential oils in human skin cells. Biochim Open. 2017 Apr 26;5:1-7. doi: 10.1016/j.biopen.2017.04.001. eCollection 2017 Dec.
- 16. Baylac D, Gupta SS. Inhibition of 5-lipoxygenase by essential oils and other natural fragrant extracts. Int J Aromatherapy 2003; 13 (2/3): 138-42.
- 17. Sala et al. Anti-inflammatory and antioxidant properties of Helichrysum italicum. J Pharm Pharmacol. 2002 Mar;54(3):365-71.
- 18. Sala et al. New acetophenone glucosides isolated from extracts of Helichrysum italicum with antiinflammatory activity. J Nat Prod. 2001 Oct;64(10):1360-2.).
- 19. da Silva GL, Luft C, Lunardelli A, Amaral RH, et al. Antioxidant, analgesic and anti-inflammatory effects of lavender essential oil. An Acad Bras Cienc. 2015 Aug;87(2 Suppl):1397-408. doi: 10.1590/0001-3765201520150056. Epub 2015 Aug 4.
- 20. Ghods AA, Abforosh NH, Ghorbani R, Asgari MR. The effect of topical application of lavender essential oil on the intensity of pain caused by the insertion of dialysis needles in hemodialysis patients: A randomized clinical trial. Complement Ther Med. 2015 Jun;23(3):325-30. doi: 10.1016/j.ctim.2015.03.001. Epub 2015 Mar 21.
- 21. Sheikhan F, Jahdi F, Khoei EM, Shamsalizadeh N, Sheikhan M, Haghani H. Episiotomy pain relief: Use of Lavender oil essence in primiparous Iranian women.Complement Ther Clin Pract. 2012 Feb;18(1):66-70. doi: 10.1016/j.ctcp.2011.02.003. Epub 2011 Mar 16.
- 22. Vakilian , Atarha M, Bekhradi R, Chaman R. Healing advantages of lavender essential oil during episiotomy recovery: a clinical trial.Complement Ther Clin Pract. 2011 Feb;17(1):50-3. doi: 10.1016/j.ctcp.2010.05.006. Epub 2010 Jun 17.
- 23. Turchi B, Mancini S, Pistelli L, Najar B, et al. Sub-inhibitory stress with essential oil affects enterotoxins production and essential oil susceptibility in Staphylococcus aureus. Nat Prod Res. 2018 Mar;32(6):682-688. doi: 10.1080/14786419.2017.1338284. Epub 2017 Jun 8.
- 24. Trudgian J, Trotman S. Ehlers-Danlos syndrome and wound healing: injury in a collagen disorder. Br J Nurs. 2011 Mar 22;20(6):10-20.
- 25. Song CY, Nam EH, Park SH, Hwang CY. In vitro efficacy of the essential oil from Leptospermum scoparium (manuka) on antimicrobial susceptibility and biofilm formation in Staphylococcus pseudintermedius isolates from dogs. Vet Dermatol. 2013 Aug;24(4):404-8, e87. doi: 10.1111/vde.12045. Epub 2013 Jun 17.
- 26. Gethin G, Cowman S. Bacteriological changes in sloughy venous leg ulcers treated with manuka honey or hydro-gel: an RCT. J Wound Care. 2008 Jun;17(6):241-4, 246-7.
- 27. Douglas MH, van Klink JW, Smallfield BM, Perry NB, et al. Essential oils from New Zealand manuka: triketone and other chemotypes of Leptospermumscoparium. Phytochemistry. 2004 May;65(9):1255-64.
- 28. Buckle J. Clinical Aromatherapy 2006: 178.
- 29. Mahboubi M, Kashani LM. The anti-dermatophyte activity of Commiphora molmol. Pharm Biol. 2016;54(4):720-5. doi: 10.3109/ 13880209.2015.1072831. Epub 2015 Oct 1.
- 30. Wanner J, Schmidt E, Bail S, Jirovetz L. Chemical composition and antibacterial activity of selected essential oils and some of their main compounds. Nat Prod Commun. 2010 Sep;5 (9):1359-64.
- 31. Tipton DA, Hamman NR, Dabbous MKh. Effect of myrrh oil on IL 1beta stimulation of NF kappaB activation and PGE2 production in human gingival fibroblasts and epithelial cells. Toxicol In Vitro. 2006 Mar;20(2):248-55. Epub 2005 Aug 19.
- 32. Dolara P, Luceri C, Ghelardini C, Monserrat C, et al. Analgesic effects of myrrh. Nature 379, 29 (04 January 1996). doi:10.1038/379029a0.
- 33. Liakos I, Rizzello L, Scurr DJ, Pompa PP, et al. All-natural composite wound dressing films of essential oils encapsulated in sodium alginate with antimicrobial properties. Int J Pharm. 2014 Mar 25;463(2):137-45. doi: 10.1016/j.ijpharm.2013.10.046. Epub 2013 Nov 5.
- 34. Schuhmacher A, Reichling J, Schnitzler P. Virucidal effect of peppermint oil on the enveloped viruses herpes simplex virus type 1 and type 2 in vitro. Phytomedicine. 2003;10(6-7):504-10.
- 35. Modarresi M, Farahpour MR, Baradaran B. Topical application of Mentha piperita essential oil accelerates wound healing in infected mice model. Inflammopharmacology. 2018 Jul 6. doi: 10.1007/s10787-018-0510-0.
- 36. Bommareddy A, Hora J, Cornish B, Dwivedi C. Chemoprevention by alpha-santalol on UVB radiation-induced skin tumor development in mice. Anticancer Res. 2007 Jul-Aug;27(4B):2185-8.
- 37. Orchard A, Viljoen A, van Vuuren S. Wound Pathogens: Investigating Antimicrobial Activity of Commercial Essential OilCombinations against Reference Strains. Chem Biodivers. 2018 Dec;15(12):e1800405. doi: 10.1002/cbdv.201800405. Epub 2018 Dec 17.
- 38. Gopinath H, Karthikeyan K. Turmeric: A condiment, cosmetic and cure. Indian J Dermatol Venereol Leprol [serial online] 2018 [cited 2018 Feb 9];84:16-21.
- 39. Alafiatayo AA, Syahida A, Mahmood M. Total anti-oxidant capacity, flavonoid, phenolic acid and polyphenol content in ten selected species of Zingiberaceae rhizomes. Afr J Tradit Complement Altern Med. 2014 Apr 3;11(3):7-13. eCollection 2014.
- 40. Naglik JR, Richardson JP, Moyes DL. Candida albicans pathogenicity and epithelial immunity. Pathog. 2014;10(8):1–4.
- 41. Chung WY, Park JH, Kim MJ, Kim HO, et al. Xanthorrhizol inhibits 12-O-tetradecanoyl-phorbol-13-acetate-induced acute inflammation and two-stage mouse skin carcinogenesis by blocking the expression of ornithine decarboxylase, cyclooxygenase-2 and inducible nitric oxide synthase through mitogen-activated protein kinases and/or the nuclear factor-kappa B. Carcinogenesis. 2007;28(1224):1231.
- 42. Lee SK, Hong CH, Huh SK, Kim SS, Oh OJ, Min HY, et al. Suppressive effect of natural sesquiterpenoids on inducible cyclooxygenase (COX-2) and nitric oxide synthase (iNOS) activity in mouse macrophage cells. J Environ Patho Toxicol Oncol. 2002;21:141–8.
- 43. Rukayadi Y, Hwang JK. In vitro activity of xanthorrhizol against Streptococcus mutans bio- films. Lett Appl Microbiol. 2005;42:400–4.
- 44. Kim M, Park H, Kim S, Kim H, et al. Effect of a new antibacterial agent, xanthorrhizol on the viability of plaque biofilm. Poster IADR/AADR/ CADR 80th, San Diego. 2002. p. 3883.
- 45. Surh YJ, Chun KS, Cha HH, et al. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals: down-regulation of COX-2 and iNOS through suppression of Nfkappa B activation. Mutat Res 480-481: 243-268, 2001.
- 46. Hwang JK, Shim JS, Baek NI, Pyun YR. Xanthorrhizol: a potential antibacterial agent from Curcuma xanthorrhiza against Streptococcus mutans. Planta Med. 2000;66:196–7.
- 47. Wahedi HM, Jeong M, Chae JK, Do SG, et al. Aloesin from Aloe vera accelerates skin wound healing by modulating MAPK/Rho and Smad signaling pathways in vitro and in vivo. Phytomedicine. 2017 May 15;28:19-26. doi: 10.1016/j.phymed.2017.02.005. Epub 2017 Mar 4.
- 48. Oryan A, Mohammadalipour A, Moshiri A, Tabandeh MR. Topical Application of Aloe vera Accelerated Wound Healing, Modeling, and Remodeling: An Experimental Study. Ann Plast Surg. 2016 Jan;77(1):37-46. doi: 10.1097/SAP.0000000000000239.
- 49. Long V. Aloe Vera in Dermatology-The Plant of Immortality. JAMA Dermatol. 2016 Dec 1;152(12):1364. doi: 10.1001/jamadermatol.2016.0077.
- 50. Hashemi SA, Madani SA, Abediankenari S. The Review on Properties of Aloe Vera in Healing of Cutaneous Wounds. Biomed Res Int. 2015;2015:714216. doi: 10.1155/2015/714216. Epub 2015 May 19.
- 51. Curto EM, Labelle A, Chandler HL. Aloe vera: an in vitro study of effects on corneal wound closure and collagenase activity. Vet Ophthalmol. 2014 Nov;17(6):403-10. doi: 10.1111/vop.12163. Epub 2014 Mar 25.
- 52. Hamman J.H. Composition and Applications of Aloe vera Leaf Gel, Review, Molecules 2008, 13, 1599-1616;).
- 53. Jarić S, Kostić O, Mataruga Z, Pavlović D, et al. Traditional wound-healing plants used in the Balkan region (Southeast Europe). J Ethnopharmacol. 2018 Jan 30;211:311-328. doi: 10.1016/j.jep.2017.09.018. Epub 2017 Sep 21.
- 54. Nicolaus C, Junghanns S, Hartmann A, Murillo R, et al. In vitro studies to evaluate the wound healing properties of Calendula officinalis extracts. J Ethnopharmacol. 2017 Jan 20;196:94-103. doi: 10.1016/j.jep.2016.12.006. Epub 2016 Dec 10.
- 55. Carvalho AF, Feitosa MC, Coelho NP, Rebêlo VC, et al. Low-level laser therapy and Calendula officinalis in repairing diabetic foot ulcers. Rev Esc Enferm USP. 2016 Jul-Aug;50(4): 628-634. doi: 10.1590/S0080-623420160000 500013.
- 56. Eghdampour F, Jahdie F, Kheyrkhah M, Taghi-zadeh M, et al. The Impact of Aloe vera and Calendula on Perineal Healing after Episiotomy in Primiparous Women: A Randomized Clinical Trial. J Caring Sci. 2013 Nov 30;2(4): 279-86. doi: 10.5681/jcs.2013.033. eCollection 2013 Dec.
- 57. Akhtar N., Zaman S. U., Khan B. A., et al. Evaluation of various functional skin parameters using a topical cream of Calendula officinalis extract. African Journal of Pharmacy and Phar-macology. 2011;5(2):199–206.
- 58. Preethi KC, Kuttan G, Kuttan R. Anti-inflammatory activity of flower extract of Calendula officinalis Linn. and its possible mechanism of action. Indian J Exp Biol 2009 Feb; 47(2):113-20.
- 59. Ukiya M, Akihisa T, Yasukawa K, et al. Anti-Inflammatory, Anti-Tumor-Promoting, and Cytotoxic Activities of Constituents of Marigold (Calendula officinalis) Flowers. Nat Prod 2006 Dec 27; 69(12):1692-1696.
- 60. Duran V, Matic M, Jovanovic M, et al. Results of the clinical examination of an ointment with marigold (Calendula officinalis) extract in the treatment of venous leg ulcers. Int J Tissue React.27(3): 101–106, 2005.
- 61. Surh YJ, Chun KS, Cha HH, et al. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals: down-regulation of COX-2 and iNOS through suppression of Nfkappa B activation. Mutat Res 480-481: 243-268, 2001.
- 62. Soliman A, Teoh SL, Ghafar N, Das S. Molecular concept of diabetic wound healing: effective role of herbal remedies. Mini Rev Med Chem. 2018 Oct 25. doi: 10.2174/1389557518666181025155204.
- 63. Ito H, Asmussen S, Traber DL, Cox RA, et al. Healing efficacy of sea buckthorn (Hippophae rhamnoides L.) seed oil in an ovine burn woundmodel. Burns. 2014 May;40(3):511-9. doi: 10.1016/j.burns.2013.08.011. Epub 2013 Sep 3.
- 64. Edraki M, Akbarzadeh A, Hosseinzadeh M, Tanideh N, et al. Healing effect of sea buckthorn, olive oil, and their mixture on full-thickness burn wounds. Adv Skin Wound Care. 2014 Jul;27(7):317-23. doi: 10.1097/01.ASW.0000451061.85540.f9.
- 65. Upadhyay NK, Kumar R, Mandotra SK, Meena RN, et al. Safety and healing efficacy of Sea buckthorn (Hippophae rhamnoides L.) seed oil on burn wounds in rats. Food Chem Toxicol. 2009 Jun;47(6):1146-53. doi: 10.1016/j.fct.2009.02.002.
- 66. Seven et al. Hippophae rhamnoides L. and dexpanthenol-bepanthene on blood flow after experi-mental skin burns in rats using 133Xe clearance technique. Hell J Nucl Med. 2009 Jan-Apr;12 (1):55-8.Gupta A, Kumar R, Pal K, Singh V, et al. Influence of sea buckthorn (Hippophae rhamnoides L.) flavone on dermal wound healing in rats. Mol Cell Biochem. 2006 Oct;290(1-2):193-8. Epub 2006 Apr 22.
- 67. Wang ZY, Luo XL, He CP. Management of burn wounds with Hippophae rhamnoides oil. Nan Fang Yi Ke Da Xue Xue Bao. 2006 Jan;26(1):124-5.
- 68. Nguyen VL, Truong CT, Nguyen BCQ, Vo TV, et al. Anti-inflammatory and wound healing activities of calophyllolide isolated from Calophylluminophyllum Linn. PLoS One. 2017 Oct 11;12(10):e0185674. doi: 10.1371/journal.pone.0185674. eCollection 2017.
- 69. Ansel JL, Lupo E, Mijouin L, et al. Biological Activity of Polynesian Calophyllum inophyllum Oil Extract on Human Skin Cells. Planta Med. 2016 Jul;82(11-12):961-6. doi: 10.1055/s-0042-108205. Epub 2016 Jun 9.
- 70. Léguillier T, Lecsö-Bornet M, Lémus C, et al. The Wound Healing and Antibacterial Activity of Five Ethnomedical Calophyllum inophyllum Oils: An Alternative Therapeutic Strategy to Treat Infected Wounds. PLoS One. 2015; 10(9): e0138602.Published online 2015 Sep 25. doi: 1371/journal.pone.0138602 PMCID: PMC4583440.
- 71. Dweck AC, Meadows T. Tamanu (Calophyllum inophyllum) – the African, Asian, Polynesian and Pacific Panacea. Int J Cosmet Sci. 2002 Dec;24(6):341-8. doi: 10.1046/j.1467-2494.2002.00160.x.
- 72. Xu YJ, Elimban V, Dhalla NS.Carbon dioxide water-bath treatment augments peripheral blood flow through the development of angiogenesis. Can J Physiol Pharmacol. 2017 Aug;95(8):938-944. doi: 10.1139/cjpp-2017-0125. Epub 2017 Jul 13.
- 73. Finzgar M, Melik Z, Cankar K. Effect of transcutaneous application of gaseous carbon dioxide on cutaneous microcirculation. Clin Hemorheol Microcirc. 2015;60(4):423-35. doi: 10.3233/CH-141898.
- 74. Fabry R, Monnet P, Schmidt J, Lusson JR, et al. (2009): Clinical and microcirculatory effects of transcutaneous CO2 therapy in intermittent claudication. Randomized double-blind clinical trial with a parallel design. Aug.2009.
- 75. Hayashi, H., Yamada, S., Kumada, Y., Matsuo, H., Toriyama, T. & Kawahara, H. (2008). Immersing Feet in Carbon Dioxide-enriched Water Prevents Expansion and Formation of Ischemic Ulcers after Surgical Revascularization in Diabetic Patients with Critical Limb Ischemia.
- 76. Akamine T., Taguchi N. (1998): Effects of an artificially carbonated bath on athletic warm-up. J. Human Ergol., 27 (1,2): 22-29, 1998.
- 77. Fink, C. Heisler, F. Candir, A. Gehrke, Chr. Gutenbrunner (1998?): Untersuchungen für die Wirkungen von CO2 Gasbädern von unterschiedlicher Temperatur und Feuchte auf Hautdurchblutung und transkutan gemessenem Sauerstoffpartialdruck.
- 78. Hartmann, B,: Drews, B., Burnus, C., Bassenge, E. (1991): Zunahme von Fußrückenhautdurchblutung und transkutanem Sauerstoffpartialdruck während Unterschenkel-Immersion in kohlendioxidhaltigem Wasser bei Patienten mit arterieller Verschlußkrankheit: Ergebnisse einer gegen Süßwasser kontrollierten Studie. VASA 20: 382-387.
- 79. Hartmann, B. (1990): Results of the consenusfinding conference on carbon dioxide balneotherapy. Z. Phys. Med. Baln. Med. Klim. (Suppl. 1) 19: 11-12.
- 80. Ernst, E, Resch, KL, Rumpf, M. (1990): Effects of CO2 baths on blood fluidity-a controlled study in 802 patients with cardiovascular diseases. Herz/Kreisl. 22: 335-338.


